Conteo de células en forma precisa, rápida y objetiva
Los especialistas en células mamíferas normalmente emplean técnicas microscópicas estandarizadas (hemocitómetro) para la determinación del número total de células.
El método de exclusión Trypan Blue es ampliamente utilizado en laboratorios para la determinación de viabilidad; solamente penetra en células cuyas membranas plasmáticas estén dañadas. Las membranas de células viables no se tiñen con el colorante pues son impermeables al mismo, y las células teñidas y las no teñidas se visualizan con un microscopio. Una de las desventajas de este método, sin embargo es la propensión del hemocitómetro a teñirse; otra desventaja es el incremento proporcional de células teñidas con el incremento del tiempo de incubación. Además, el ojo humano puede solamente diferenciar entre células en un rango de concentración limitado en la cámara del hemocitómetro. Esto, combinado con el problema potencial del agregado de las células y el limitado volumen de muestra, llevan a la variación tan común que este método tiene asociada.
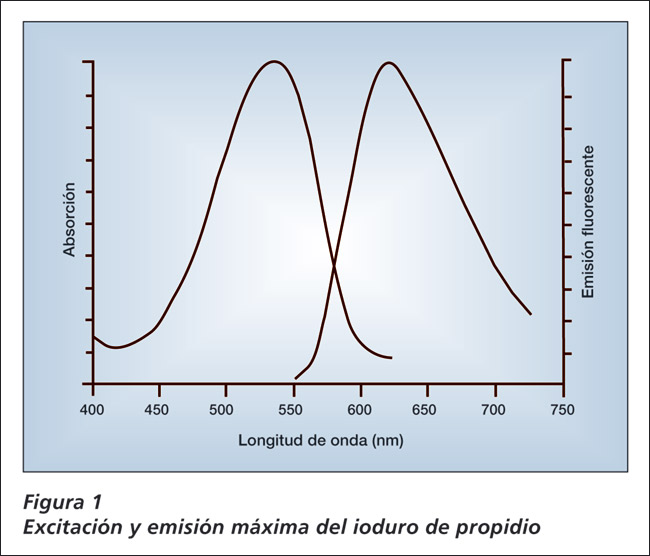
Para solucionar esto Chemometec A/S desarrolló el NucleoCounter, que está basado en una técnica de conteo con un microscopio fluorescente. El NucleoCounter está actualmente optimizado para el conteo de células mamíferas (células mamíferas, somáticas, espermáticas, y levaduras) en investigación y producción (frascos T, bio reactores, etc.). El microscopio fluorescente integrado en el NucleoCounter está diseñado para detectar señales de un colorante fluorescente, ioduro de propidio (PI) Figura 1), el que se intercala en el ADN del núcleo celular.
La excitación del ioduro de propidio (PI) (Figura 1) ocurre a 540 nm (luz verde) y la emisión (fluorescencia) ocurre mayormente a 600 nm (luz roja).
La intensidad de la señal es mejorada por un factor de 20-30 cuando el PI se une al ADN lo que mejora la relación señal - ruido.
El NucleoCounter detecta más el PI teñido del núcleo que las células individuales. Debido a que los núcleos son virtualmente uniformes en tamaño, independientemente del tipo de célula, no hace falta una calibración especial debida al tamaño o morfología de las células. Células heterogéneas como las de adipocitos o CHO (chinese hámster ovary) fueron medidas sin la realización de ningún tipo de ajuste en el instrumento. Combinado con una cámara con CCD (charge couple device) y un análisis integrado de la imagen, el microscopio compacto está diseñado para permitir que células pequeñas y grandes puedan ser contadas en forma rápida, eficiente y reproducible.
Para solucionar esto Chemometec A/S desarrolló el NucleoCounter, que está basado en una técnica de conteo con un microscopio fluorescente. El NucleoCounter está actualmente optimizado para el conteo de células mamíferas (células mamíferas, somáticas, espermáticas, y levaduras) en investigación y producción (frascos T, bio reactores, etc.). El microscopio fluorescente integrado en el NucleoCounter está diseñado para detectar señales de un colorante fluorescente, ioduro de propidio (PI) Figura 1), el que se intercala en el ADN del núcleo celular.
La excitación del ioduro de propidio (PI) (Figura 1) ocurre a 540 nm (luz verde) y la emisión (fluorescencia) ocurre mayormente a 600 nm (luz roja).
La intensidad de la señal es mejorada por un factor de 20-30 cuando el PI se une al ADN lo que mejora la relación señal - ruido.
El NucleoCounter detecta más el PI teñido del núcleo que las células individuales. Debido a que los núcleos son virtualmente uniformes en tamaño, independientemente del tipo de célula, no hace falta una calibración especial debida al tamaño o morfología de las células. Células heterogéneas como las de adipocitos o CHO (chinese hámster ovary) fueron medidas sin la realización de ningún tipo de ajuste en el instrumento. Combinado con una cámara con CCD (charge couple device) y un análisis integrado de la imagen, el microscopio compacto está diseñado para permitir que células pequeñas y grandes puedan ser contadas en forma rápida, eficiente y reproducible.
Método
Determinación del número total de células
La determinación del número total de células involucra la preparación de la muestra y su análisis. Durante la preparación de la misma, una muestra representativa de la suspensión (200 ul) es mezclada con la misma cantidad de un buffer para desagregado y lisado (Reactivo A) y mezclado.
Otro reactivo, de estabilización (Reactivo B), en la misma cantidad es agregado a la mezcla lisada mezclando nuevamente. Este lisado celular se introduce en un NucleoCassette, donde el núcleo es teñido por el PI. Introduciendo la punta del Nucleocassette en la muestra y presionando un pequeño pistón que tiene el cassette, se succionan los 50 ul pre definidos.
El NucleoCassette es colocado luego en el NucleoCounter para el análisis. El lisado disuelve el PI, que está inmovilizado en el cassette, y después que el pistón vuelva a ser impulsado, ahora por una parte del equipo, la muestra es impulsada hacia la cámara de medición del cassette. Durante el análisis la señal fluorescente es registrada y correlacionada con el conteo total de células. La concentración total de células presentes en el NucleoCassette es presentada en el display del equipo en células por ml. Opcionalmente los datos pueden ser presentados en una PC a través del software NucleoView.
Otro reactivo, de estabilización (Reactivo B), en la misma cantidad es agregado a la mezcla lisada mezclando nuevamente. Este lisado celular se introduce en un NucleoCassette, donde el núcleo es teñido por el PI. Introduciendo la punta del Nucleocassette en la muestra y presionando un pequeño pistón que tiene el cassette, se succionan los 50 ul pre definidos.
El NucleoCassette es colocado luego en el NucleoCounter para el análisis. El lisado disuelve el PI, que está inmovilizado en el cassette, y después que el pistón vuelva a ser impulsado, ahora por una parte del equipo, la muestra es impulsada hacia la cámara de medición del cassette. Durante el análisis la señal fluorescente es registrada y correlacionada con el conteo total de células. La concentración total de células presentes en el NucleoCassette es presentada en el display del equipo en células por ml. Opcionalmente los datos pueden ser presentados en una PC a través del software NucleoView.
Determinación de viabilidad
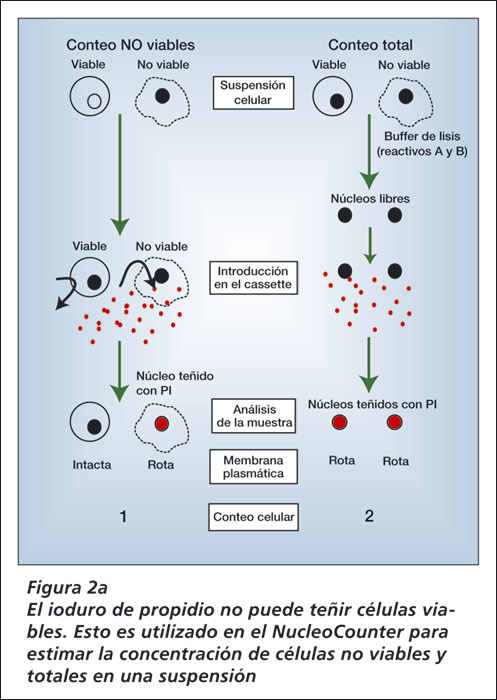

Como se mencionó anteriormente, el conteo total de células es obtenido debido al deliberado rompimiento de las membranas plasmáticas de las células en la muestra mediante el pre tratamiento con el Reactivo A y el B. Todos los núcleos estarán pues susceptibles de teñirse con el PI, independientemente de que antes de la lisis que provoca el Reactivo A las mencionadas células fueran viables o no.
Sin embargo, si se coloca una muestra sin el pre tratamiento (sin agregado de Reactivo A ni B) directamente en el NucleoCassette sólo las células con la membrana previamente dañada serán teñidas con el PI (Figura 2a).
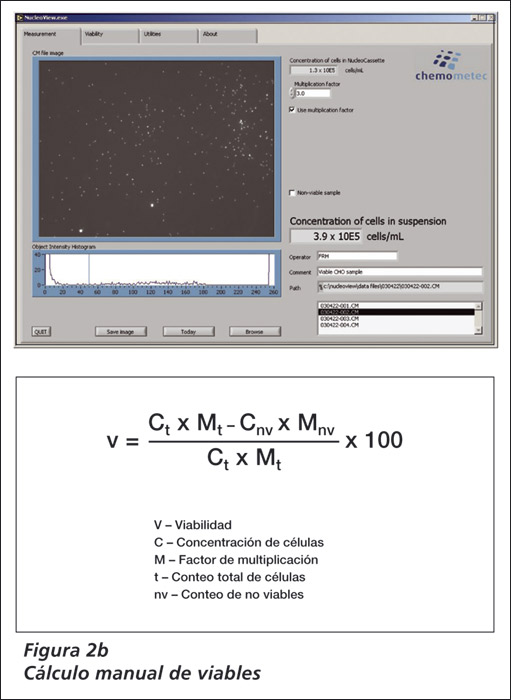
Luego, el análisis en el NucleoCounter mostrará la concentración de las células no viables de la suspensión inicial. Basándose en estas dos mediciones, se puede calcular la viabilidad (Figura 2b) y se puede mostrar en el software NucleoView.
Sin embargo, si se coloca una muestra sin el pre tratamiento (sin agregado de Reactivo A ni B) directamente en el NucleoCassette sólo las células con la membrana previamente dañada serán teñidas con el PI (Figura 2a).
Luego, el análisis en el NucleoCounter mostrará la concentración de las células no viables de la suspensión inicial. Basándose en estas dos mediciones, se puede calcular la viabilidad (Figura 2b) y se puede mostrar en el software NucleoView.
Discusión y conclusiones
 Como ya fue indicado previamente, una de las principales desventajas del conteo manual clásico es la naturaleza subjetiva del mismo. Ocurre a menudo que los conteos de distintos especialistas en conteo de células, presenten inconsistencias ya sea en el conteo total y/o en la viabilidad. Dicha variación entre especialistas, conlleva lamentablemente a complicaciones en otras aplicaciones posteriores, especialmente cuando la exactitud es crítica para la validez de dicho análisis.
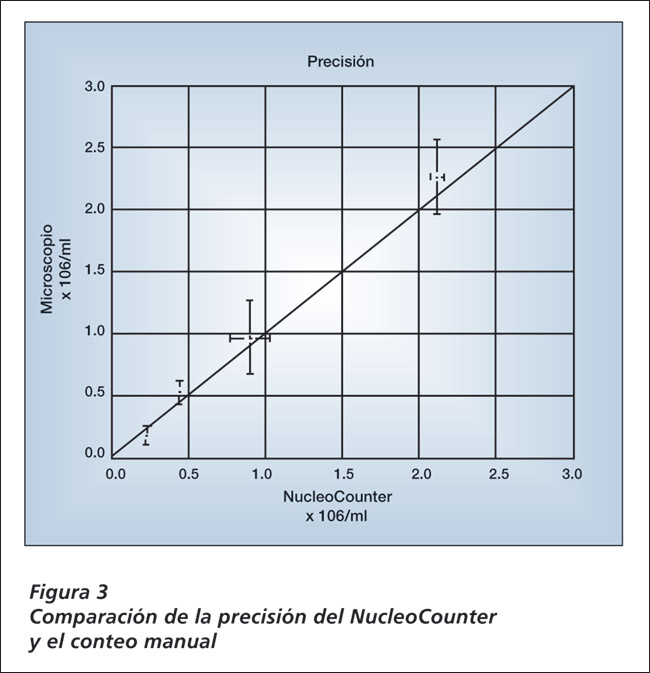
Como ya fue indicado previamente, una de las principales desventajas del conteo manual clásico es la naturaleza subjetiva del mismo. Ocurre a menudo que los conteos de distintos especialistas en conteo de células, presenten inconsistencias ya sea en el conteo total y/o en la viabilidad. Dicha variación entre especialistas, conlleva lamentablemente a complicaciones en otras aplicaciones posteriores, especialmente cuando la exactitud es crítica para la validez de dicho análisis.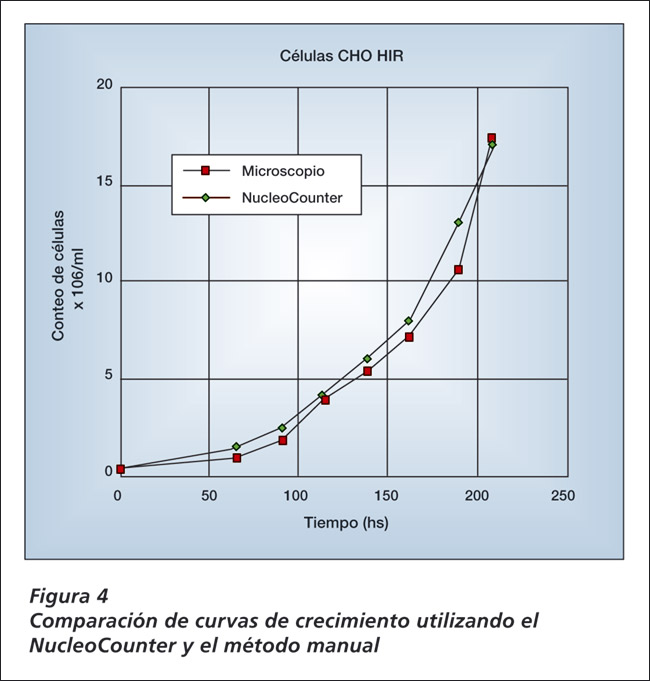 Muestras de células CHO HIR (chinese hámster ovary) con concentraciones conocidas fueron contadas en forma manual y comparadas con lecturas hechas en el NucleoCounter en muestras idénticas (Figura 3). Determinación de concentraciones hechas por triplicado indicaron que la precisión alcanzada con el NucleoCounter fue superior a la lograda con el método manual.
Muestras de células CHO HIR (chinese hámster ovary) con concentraciones conocidas fueron contadas en forma manual y comparadas con lecturas hechas en el NucleoCounter en muestras idénticas (Figura 3). Determinación de concentraciones hechas por triplicado indicaron que la precisión alcanzada con el NucleoCounter fue superior a la lograda con el método manual.Como indican las barras de error, las desviaciones estándar del microscopio (método manual) son indicativas de la alta variabilidad de la técnica, mientras que las lectura hechas con el NucleoCounter mantuvieron una mejor uniformidad en un amplio rango de conteos.
Además, se vio claramente que las lecturas hechas con el NucleoCounter generaron coeficientes de variación (CV) menor al 5% bajo condiciones normales.
Adicionalmente, las muestras fueron tomadas en distintos momentos desde frascos T, tripsinizadas y re suspendidas en DMEM. Las células fueron lisadas con Triton X-100 al 2% y los conteos fueron obtenidos con ambos métodos, el manual y el NucleoCounter (Figura 4).
La comparación de los datos muestran curvas con idéntico crecimiento con cualquier método. Sin embargo, el tiempo requerido para adquirir los datos usando el NucleoCounter fue una fracción del que se requiere con el método manual.
Pasos para realizar un análisis
NucleoCounter




Finalmente, otros métodos automáticos de conteo celular en uso, no han logrado solucionar estos puntos críticos de reproducibilidad y velocidad en un nivel satisfactorio. Hasta la fecha, los métodos automáticos para la determinación de viabilidad están basados en el método de Trypan blue o bien en la diferenciación del distinto tamaño celular usando impedancia. Muchos de estos sistemas requieren calibraciones frecuentes debido al tamaño o morfología celular antes de ser usados y por ello estos requerimientos comprometen la exactitud del resultado final. Como ya fue mencionado, el NucleoCounter ofrece alta precisión, bajo mantenimiento y no requiere calibración para distintos tipos de células.
Esta nota ha sido traducida y adaptada de Life Science Asia, año 2004 por personal técnico de TecnoCientífica SH
Fuente: TecnoCientifica










































No hay comentarios:
Publicar un comentario
Bienvenido a Avibert.
Deja habilitado el acceso a tu perfil o indica un enlace a tu blog o sitio, para que la comunicación sea mas fluida.
Saludos y gracias por comentar!