Residuos de Organofosforados en Leche Implementación de Métodos Analíticos
Pinto Bastos, Vieira Gouvêa, Málaga, Morelli Cardoso, Couto Jacob y Wanderley da Nóbrega

Se ha desarrollado un estudio, para la implementación de métodos analíticos, para la determinación de residuos de organofosforados en leche por cromatografía a gas con detector fotométrico de llama.
Uno de los países que más utiliza agrotóxicos (agroquímicos) es Brasil. En 2009, cerca de 720.000 t de productos comerciales formulados fueron vendidos, correspondiendo a 330.000 t de ingredientes activos. (1) El estudio de la clase de los organofosforados tiene gran importancia, debido a su uso intensivo y su alta toxicidad. (2).
Los agrotóxicos son utilizados como la principal estrategia en el combate y prevención de plagas agrícolas y en el aumento de la producción de alimentos. Con todo así, los residuos y trazas de estos principios activos y de sus productos de degradación pueden quedar en los alimentos y necesitan ser monitoreados para analizar la ingestión del agente químico residual. (3)
La leche cuenta con un alto consumo a nivel nacional y puede contener residuos de agrotóxicos provenientes de diferentes fuentes, como contaminación de pastos, raciones y cereales; contaminación del medio ambiente; uso de desinfectantes en los corrales y establecimientos de producción lechera y el empleo de productos veterinarios en el ganado lechero. (4)
Los agrotóxicos son utilizados como la principal estrategia en el combate y prevención de plagas agrícolas y en el aumento de la producción de alimentos. Con todo así, los residuos y trazas de estos principios activos y de sus productos de degradación pueden quedar en los alimentos y necesitan ser monitoreados para analizar la ingestión del agente químico residual. (3)
La leche cuenta con un alto consumo a nivel nacional y puede contener residuos de agrotóxicos provenientes de diferentes fuentes, como contaminación de pastos, raciones y cereales; contaminación del medio ambiente; uso de desinfectantes en los corrales y establecimientos de producción lechera y el empleo de productos veterinarios en el ganado lechero. (4)
En este trabajo fue analizada la implementación del método analítico para la determinación en la matriz leche de residuos de 49 agrotóxicos y de 4 productos de degradación de la clase de los organofosforados. De entre los organofosforados analizados el 75% son permitidos para el uso en la agricultura de cereales y hortofrutícolas de granja, aproximadamente el 15% están presentes en medicamentos veterinarios y cerca del 20% poseen su uso permitido como desinfectante. (5)
A pesar de que el 15% de los organofosforados estudiados no poseen el uso permitido dentro del territorio brasileño, fueron incluidos en la validación de método por las necesidades nacionales de análisis de las buenas prácticas agrícolas. Los agrotóxicos clorfenvinfós, clorpirifós, diazinona, diclorvós, etiona y fenitrotiona son utilizados en medicamentos veterinarios para el combate a ectoparasitos y, excepto el diclorvós, son también utilizados en hortofrutícolas de granja, cereales y desinfectantes, representando cuatro posibles medios de dejar sus residuos en la leche. (4,6)
La complejidad de la composición de los alimentos trae dificultades para la cuantificación de los agrotóxicos, siendo necesaria una etapa de limpieza do extracto (clean up) para reducir las interferencias luego de la extracción con solvente. Estas dificultades fueron minimizadas luego del desarrollo de métodos multi-residuales que hicieron posible el análisis de un gran número de sustancias con altos porcentajes de recuperación (exactitud) de los analitos y la remoción de las posibles interferencias de la muestra; presentaron una buena precisión y robustez y redujeron el trabajo técnico y el uso de solventes. (7,8)
Teniendo en cuenta que la legislación brasileña permite el uso de más de 200 ingredientes activos en la agricultura y como desinfectantes, la utilización de métodos multi-residuales es importante para agilizar el trabajo analítico y así responder a las demandas de la salud pública. (3)
Se introdujo un nuevo método de preparación de muestra para la extracción de residuos de agrotóxicos que recibió el nombre de fantasía de QuEChERS. Este método busca reflejar las mayores ventajas (Quick, Easy, Cheap, Effective, Rugged, Safe), o sea, ser rápido, fácil, económico, efectivo, robusto y seguro.
Las etapas que conforman el método son extracción con acetonitrilo seguido de partición, promovida por la adición de sales (sulfato de magnesio-MgSO4), cloruro de sodio (NaCl) y/o acetato de sodio (Na(C2H3O2) y limpieza de la muestra con sorbentes, como C18, alúmina, PSA (primary secondary amine) y carbono con grafito (para uso en muestras con clorofila).
La utilización del solvente acetonitrilo permite la extracción de una amplia franja de agrotóxicos con diferentes polaridades y cuando es acidificada, favorece la extracción de sustancias que presentan problemas de estabilidad en un medio básico. El uso de acetonitrilo, no es adecuado para análisis en cromatografía a gas en el modo splitless, debido a su gran expansión de volumen durante la vaporización, lo que puede interferir en los detectores selectivos y favorecer la degradación de algunos agrotóxicos. (10)
En función de esto en este estudio, luego del proceso de extracción con acetonitrilo, en la etapa final el extracto orgánico fue secado y el solvente reemplazado por acetato de etilo, más adecuado a la cromatografía a gas con detección por fotometría de llama (CG-DFC). La utilización de la sal secante, sulfato de magnesio, tiene como objetivo la remoción del agua y el favorecer la recuperación de los agrotóxicos polares. En contrapartida, la hidratación del sulfato de magnesio, genera una reacción exotérmica que calienta la muestra a temperaturas de 40°C a 45°C en la etapa de extracción/partición, favoreciendo la recuperación de los agrotóxicos apolares. (11)
El método QuEChERS introdujo una nueva denominación al procedimiento de limpieza de la muestra, llamada de extracción en fase sólida dispersiva (D-SPE) en la cual, diferentemente del procedimiento de limpieza tradicional (SPE) que utiliza cartuchos ó columnas, los sorbentes son adicionados directamente al extracto orgánico y permiten que la limpieza de la muestra y la reducción del agua residual sean realizados concomitantemente. (9) El método ha demostrado ser el adecuado también para muestras con bajos tenores de gordura (< 2% de gordura) con la leche (12) pasteurizada a Ultra-alta temperatura (UAT).
El objetivo del trabajo fue la implementación del método de extracción dispersiva QuEChERS en la leche integral UAT en embalaje Tetra Pak y leche pasteurizada en embalaje plástico, para la determinación de residuos de agrotóxicos de la clase de los organofosforados. Fueron analizados 49 agrotóxicos de la clase de los organofosforados y 4 productos de degradación, totalizando 53 sustancias.
Parte Experimental
Muestras de leche blanca (matriz)
Dos muestras de leche integral provenientes del estado de Minas Gerais – una en embalaje Tetra Pak (UAT) y otra en embalaje plástico (leche pasteurizada tipo A) – fueron analizadas en la etapa de implementación del método. Como en los respectivos rótulos constaba la información de que ambas eran de procedencia orgánica, fue efectuado un análisis previo para confirmar la ausencia de los agrotóxicos en estudio.
Patrones y reactivos
La mayoría de los patrones de agrotóxicos certificados de la clase de los organofosforados, posee grado de pureza superior a 95% (Dr. Ehrenstorfer – Augsburg, Alemanha), excepto los agrotóxicos: tiometona (48%), profenofós (92%), mevinfós (91%), etoprofós (93%), terbufós (93%), etrinfos (60%), fosfamidona (92,5%), formotiona (92%), fenamifós (92,5%) y triazofós (78%).
Fueron utilizados acetonitrilo, iso-octano y acetato de etilo, solventes orgánicos de alta pureza y grado cromatográfico (Merck y Tedia); MgSO4 PA (Merck); sorbente Bondesil-PSA 40 mm (Varian); C18 35-75 mm (Alltech); Al2O3, 90, neutro70-230 # ASTM (Merck), previamente pasado por mufla a 550°C por 3 horas y Na(C2H3O2) anidro (Spectrum) secado a 220°C por 3 horas antes de ser usado.
Soluciones de stock
Fueron preparadas 53 soluciones de stock (SS) de los agrotóxicos y/o derivados a ser evaluados en solvente acetato de etilo en la concentración nominal de 100 mg mL-1.
Soluciones intermediarias
A partir de las soluciones de stock (SS), fueron preparadas dos soluciones distintas (S1 y S2) intermediarias de trabajo. La elección de los agrotóxicos de cada solución fue hecha en función del tiempo de retención de cada sustancia, de modo que no hubiese dos con el mismo tiempo de retención en minutos (tR min), haciendo posible de esa forma, una separación inequívoca de todos los organofosforados evaluados. Cuando se detecta en la determinación analítica de una muestra desconocida, la presencia de agrotóxicos con el mesmo "tR min", la identidad del analito deberá ser confirmada por el empleo de por lo menos, uno de los siguientes procedimientos: (13) otra columna con fase estacionaria de polaridad diferente, otro detector ó espectrometría de masas con identificación por la biblioteca de espectros de los agrotóxicos.
La S1 fue compuesta de los siguientes agrotóxicos y de productos de degradación, ordenados en orden crescente de "tR min", entre paréntesis: nalede (3,694), metamidofós (4,322), acefato (7,287), demetom-S-metílico (10,228), ometoato (11,482), tiometona (12,403), diazinona (13,291), dissulfotom (14,770), isazofós (17,123), clorpirifós-metil (19,805), parationa-metílica (21,560), pirimifós-metílico (22,053), paraoxon etílico (22,440), fenitrotiona (24,385), parationa-etílica (24,945), bromofós-metílico (29,762), bromofós-etílico (29,762), protiofós (33,690), profenofós (37,002), dissulfotom-S-sulfurona (40,815), etiona (40,950), metidationa (44,849), carbofenotiona (48,435), fosalona (66,500), pirazofós (69,337) y azinfós-Etílico (72,718). El paraoxon-etílico y la disulfotom-S-sulfurona son productos de degradación de la parationa-etílica y del disulfotom, respectivamente.
La S2 fue compuesta de los siguientes agrotóxicos y de dos de los productos de degradación, también ordenados en orden creciente de "tR min": diclorvós (3,699), mevinfós (5,710), etoprofós (9,105), forato (11,315), terbufós (12,411), tebupirinfós (12,571), monocrotofós (14,589), etrinfos (15,241), dimetoato (16,403), paraoxon-metílico (20,634), fosfamidona (21,813), formotiona (22,180), malaoxon (23,509), clorpirifós (24,646), malationa (25,545), pirimifós-etílico (27,276), fentiona (27,803), clorfenvinfós (30,705), tetraclorvinfós (35,711), iodofenfós (37,429), fenamifós (38,004), vamidotiona (41,968), sulprofós (47,676), triazofós (55,106), piridafentiona (63,645), fosmete (66,536), azinfós-metílico (71,084). El paraoxon-metílico y el malaoxon son productos de degradación da parationa-metílica y malationa, respectivamente.
Las Figuras 1 y 2 presentan los cromatogramas de las S1 y S2 de los agrotóxicos estudiados en la matriz de leche.
Las S1 y S2 fueron utilizadas para preparar las curvas analíticas en acetato de etilo, en el extracto de leche orgánico blanco y en la fortificación del leche blanco en el estudio de la tasa de recuperación.
Soluciones intermediarias utilizadas en la calidad garantizada
Para garantizar el control individual del proceso analítico y la validad de los resultados, fueron utilizadas dos soluciones intermediarias (QA1 y QA2): clorpirifós-metil, en la concentración nominal de 0,3 μg mL-1 en el solvente de acetato de etilo (QA1), fue escogido por mL-1 por representar adecuadamente las características físicas y químicas de la clase de los organofosforados.(14)
Los resultados analíticos de la muestra son considerados válidos si la recuperación del clorpirifós-metil estuviese entre 70% y 120%. En el caso contrario, debe verificarse todo el procedimiento realizado y si fuese necesario, repetir el proceso de extracción y limpieza de la muestra. (13)
Para el control del equipo, la parationa-metílica, en la concentración nominal de 1 μg mL-1 en acetato de etilo (QA2), fue adicionada en el inicio de cada secuencia de inyección, con el objetivo de monitorear el sistema cromatográfico en el momento del análisis de las muestras.
El criterio de evaluación adoptado fue el CV de 10% para el área obtenida en el QA2. Con todo así un nuevo CV podrá ser determinado con base en una serie histórica de sucesivas evaluaciones.
Condiciones Cromatográficas
Equipo: Cromatógrafo a Gas HP 7890 (Agilent), equipado con detector por fotometría de llama (CG-DFC) en modo fósforo (P); sistema de inyección automático y estación de trabajo - ChemStation. Temperaturas del inyector y detector de 230ºC y 250ºC, respectivamente. Columna 50% fenil-metil siloxano (DB-17MS) con 30 m de longitud; 0,25 mm de d.i. y 0,25 mm de espesura del film. Programación de temperatura del horno de 100ºC (0 min), 25 ºC/min a 170ºC (1 min), 1 ºC/min a 180ºC (1 min), 1 ºC/min hasta 230°C (0 min), 5 °C/min hasta 260°C (5 min), 20 ºC/min hasta 280°C (10 min). Flujo de gas portador (hélio) = 1,5 mL min-1, flujo de la purga del septo = 3,0 mL min-1, flujo total = 61,5 mL min-1, flujo del gás make-up (nitrógeno) = 60 mL min-1, modo de inyección splitless = 1,0 min, volumen inyectado = 1,0 mL.
El tiempo total de la corrida fue de 80 min y la integración fue hecha por el parámetro del área de los picos.
Procedimiento analítico multi-residuos
El método multi-resíduos utilizado fue basado en la metodología (9) desarrollada en 2003, denominada QuEChERS.
Extracción de los agrotóxicos
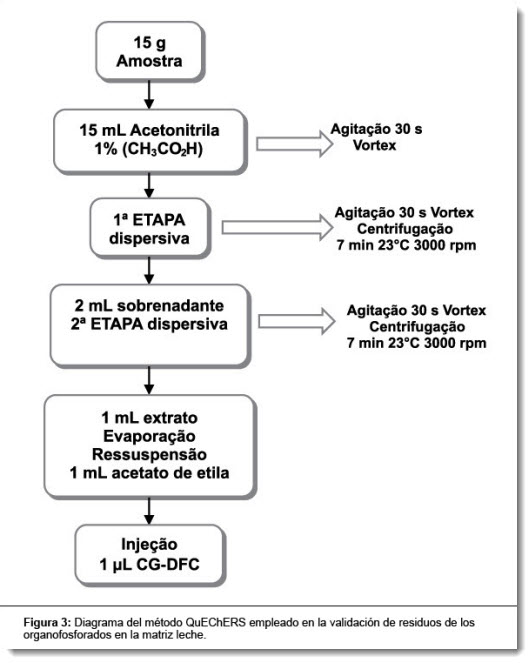
Cerca de 15 g de la muestra, luego de la homogeneización por 5 min en licuadora de vaso de vidrio, fueron pesadas y colocadas en frasco de 50 mL para uso en centrífuga. En seguida, fue añadido 1 mL del QA1 (clorpirifós-metil) y homogeneizado. Luego de 25 min, fue iniciada la extracción con la adición de 15 mL de acetonitrilo (1% ácido acético) y agitación en Vortex. Fueron realizadas dos etapas de la limpieza de la muestra con extracción en fase sólida dispersiva (SPE-D): en la primera, fueron añadidos MgSO4 + 1,5 g Na(C2H3O2) y en la segunda, fueron estudiadas varias combinaciones de sorbentes, que se encuentran indicados en el listado abajo citado de este texto. El diagrama de dos etapas de extracción dispersiva se encuentra representado en la Figura 3.
Criterios utilizados en la evaluación do método
El primer criterio a ser evaluado fue el de la selectividad, luego de este se evaluó la mejor combinación de sorbentes en la fase estacionaria para la segunda etapa de la SPE-D, el efecto matriz, la linealidad, la precisión, la exactitud, los limites de detección y cuantificación.
Selectividad
Las muestras blanco matriz de la leche fueron sometidas al método de extracción de organofosforados y la selectividad fue confirmada por la ausencia de picos en los tiempos de retención de las sustancias estudiadas presentes en las S1 y S2. (14)
Evaluación de la mejor combinación de sorbentes para la extracción en fase sólida dispersiva (SPE-D)
Las muestras blanco fueron fortificadas, respectivamente, con las concentraciones que variaron de 0,050 a 0,100 mg kg-1 de las S1 y S2, de acuerdo con los organofosforados estudiados. Luego de 25 min de la fortificación, que permitió la interacción entre el agrotóxico y la matriz, se inició el proceso de extracción. Fueron utilizadas seis diferentes combinaciones de sorbentes para la evaluación de la mejor tasa de recuperación de los organofosforados adicionados en la S1 y S2: A) 50 mg PSA + 150 mg MgSO4; B) 50 mg C18 + 150 mg MgSO4; C) 50 mg alúmina + 150 mg MgSO4; D) 50 mg PSA + 50 mg C18 + 150 mg MgSO4; E) 50 mg PSA + 50 mg alúmina + 150 mg MgSO4 y F) 50 mg PSA + 50 mg C18 + 50 mg alúmina + 150 mg MgSO4.
En seguida, las recuperaciones de los 53 analitos presentes en la S1 y S2 fueron evaluadas y comparadas con la concentración real de las muestras fortificadas (leche con S1 o S2).
Efecto de la respuesta cromatográfica acentuada e inducida por la matriz blanco de leche
La naturaleza de la matriz ("efecto matriz") - solventes orgánicos (15) o el extracto de la muestra - que contiene los analitos puede aumentar o disminuir la respuesta del detector.
Para evaluarse este efecto, se siguió el procedimiento (16) que identificó la respuesta cromatográfica de cada organofosforado en el solvente y en la matriz de tomate. Se utilizó la matriz leche integral UAT y fueron analizadas las soluciones S1 y S2 en cinco diferentes niveles, correspondientes a las concentraciones nominales de 0,01; 0,02; 0,03; 0,04 y 0,05 mg mL-1.
Estudio de la linealidad de la franja de trabajo
Para el estudio de la linealidad de la franja de trabajo, 1 mL del extracto orgánico del blanco de leche, colocado en frascos de vidrio de 3 mL, fue secado en una atmósfera de N2. En seguida, se le añadió 1 mL de los extractos orgánicos S1 y S2, respectivamente, en las concentraciones correspondientes a los puntos de la curva analítica (0,01 a 0,05 mg mL-1).
El volumen de 1 μL de cada concentración fue inyectado en triplicata en el sistema CG-DFC y para los cálculos estadísticos, se utilizó el valor medio de los resultados obtenidos.
La linealidad de la franja de trabajo fue verificada a través de la lectura de la curva analítica, utilizando el método de los mínimos cuadrados ordinarios (MMQO). (16)
Límites de detección y de cuantificación del instrumento y del método
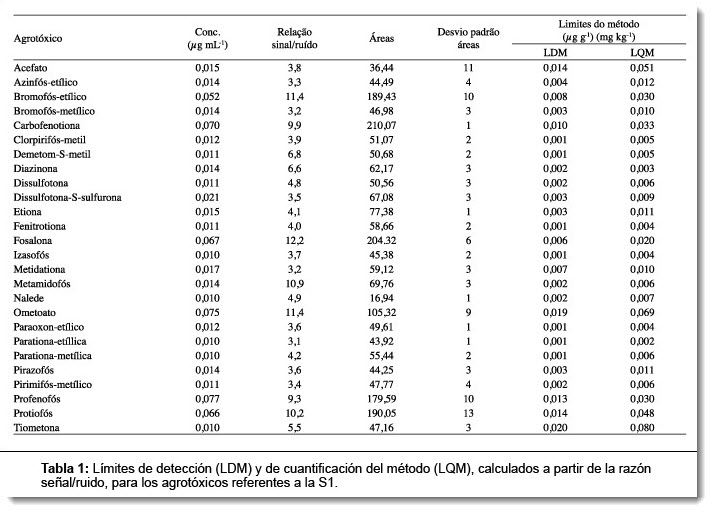
Los límites de detección y cuantificación del instrumento (LDI y LQI) y del método (LDM y LQM) fueron establecidos con base al método de la relación señal/ruido (S/R), en el cual se acepta la estimación de 3:1 para el LD y de 10:1 para el LQ, o sea, el ruido producido por la respuesta de la inyección de concentraciones conocidas de los analitos de interés debe ser tres veces mayor de que el ruido producido por el sistema cromatográfico de la línea de base para el LD y diez veces para el LQ.16 Esta relación (S/R) fue calculada por la ChemStation del cromatógrafo HP-7890.
Para establecer esta relación para los valores de los LDI y LQI se utilizó una concentración conocida con aproximadamente 0,01 mg mL-1 de todos los agrotóxicos en matriz (extracto blanco de la pulpa de leche en acetato de etilo), analizados en tres replicatas genuinas (n = 3).
Para el cálculo de LDM y LQM, seis replicatas genuinas de la muestra blanca de leche fueron fortificadas con la concentración de aproximadamente 0,01 mg mL-1 y analizadas por el método de ensayo. Los resultados obtenidos fueron utilizados para establecer la relación (S/R). En seguida, se calcularon las medias, los desvíos patrón de los resultados y los valores de los límites LDI, LQI, LDM y LQM.
Para confirmación de los resultados de los analitos fueron preparadas seis replicatas de la muestra blanco de leche en las concentraciones obtenidas de los LQM, calculados de cada analito analizado de acuerdo con el método de ensayo. En el caso de los analitos cuyos valores S/R no fueron iguales o superiores a 3:1, las concentraciones individuales fueron aumentadas, lo que permitió la obtención de valores más próximos del LDM y LQM.
Recuperación y repetitividad
El mismo procedimiento utilizado para el cálculo del LDM y del LQM fue usado para el cálculo de la tasa de recuperación y repetitividad de los 53 analitos y los criterios de aceptación fueron los indicados por el Codex Alimentarius (17) y SANCO (13): para la franja de concentración de este estudio (>0,01 y ≤ 0,1 mg kg-1), el intervalo de recuperación debe ser de 70% a 120% y los coeficientes de variación (CV) deben ser inferiores a 20%.
Resultados y Discusión
Selectividad
Las dos muestras blanco de leche utilizadas como matriz fueron adecuadas para la evaluación del método, por no haber presentado tR min iguales a los de los agrotóxicos en estudio.
Evaluación de mejor combinación de sorbentes para la utilización en la segunda fase dispersiva
De entre las seis combinaciones de sorbentes analizadas, apenas las con 50 mg PSA + 50 mg alúmina + 150 mg MgSO4 y con 50 mg PSA + 50 mg C18 + 50 mg alúmina + 150 mg MgSO4 demostraron mayor uniformidad en las recuperaciones para el conjunto de agrotóxicos evaluados en las mezclas S1 y S2, considerando la franja estipulada por el SANCO (13) (70% a 120%). La combinación 50 mg PSA + 50 mg alúmina + 150 mg MgSO4 fue la escogida, para ser utilizada en la segunda fase dispersiva, por presentar un desempeño mejor para los organofosforados acefato y clorfenvinfós (99 y 81%, respectivamente), cuando comparada con la de 50 mg PSA + 50 mg C18 + 50 mg alúmina + 150 mg MgSO4 (65 y 63%) y por utilizar una fase dispersiva a menos (C18).
En un trabajo anterior (12) el método Quechers en leche (tipo de leche no especificado) fue evaluado por CG-MS para diferentes agrotóxicos, de entre esos el acefato. Fue obtenida una recuperación para el agrotóxico estudiado de 107% (n = 3), en la concentración de 0,05 mg kg-1, utilizando la fase dispersiva 50 mg PSA + 50 mg C18 + 150 mg MgSO4. En este estudio solamente fue evaluada esa combinación, no habiendo sido evaluado también el agrotóxico clorfenvinfós.
Para los agrotóxicos estudiados (S1 y S2), las concentraciones utilizadas para fortificar la matriz y los resultados de las recuperaciones obtenidas con las seis diferentes combinaciones de sorbentes están descriptas en la Tabla 2S, material suplementario, en la cual es posible verificar las mejores tasas de recuperación (70% a 120%) en un mayor número de agrotóxicos evaluados. El agrotóxico diclorvós - también denominado DDVP – no presentó una recuperación adecuada con ninguna de las combinaciones estudiadas, lo que puede estar relacionado a varios factores, como la integridad del material de referencia utilizado o la extracción de la molécula.
El trabajo de monitoreo realizado en España (2) mostró la presencia de residuos de diclorvós en 5,78% de las muestras evaluadas en leche cruda.
Como el DDVP está presente en 39 medicamentos veterinarios antiparasitarios y es también un producto de degradación de 21 productos cuyo ingrediente activo es el triclorfom (no evaluado en este método), ambos utilizados en el ganado lechero, conforme los registros en el MAPA18, nuevos estudios deberán ser realizados para adecuar un método para análisis de este organofosforado.
Efecto de la respuesta cromatográfica acentuada e inducida por la matriz blanco de leche
En 30% de todos los agrotóxicos analizados - acefato, azinfós-etílico, demetom-S-metílico, dimetoato, fenamifós, formotiona fosfamidona, fosmete, malaoxon, metamidofós, ometoato, paraoxon-metílico, profenofós, monocrotofós, piridafentiona, tetraclorvinfós, triazofós y vamidotiona - el efecto matriz fue significante en los cinco niveles analizados.
En 12% - azinfós-metilico, etoprofós, nalede, protiofós, fentiona, pirimifós-etílico, terbufós - no fue demostrado efecto matriz en ninguno de los niveles evaluados (0,01; 0,02; 0,03; 0,04 y 0,05 mg mL-1). En los 58% restantes, correspondientes a los 28 agrotóxicos, el efecto matriz fue observado en al menos un nivel. El detalle de la presencia del efecto matriz en diferentes niveles se encuentra representado en la Tabla 1S del material suplementario.
Teniendo en cuenta el efecto matriz blanco de leche fue significante para la mayoría de los organofosforados analizados, se utilizó una curva con matriz para determinar la linealidad y la franja de trabajo.
Estudio de la linealidad y de la franja de trabajo
La correlación de la curva analítica, representada por el modelo matemático entre los valores numéricos de x y de y, es indicada por el coeficiente de Pearson – 'r'. El cuadrado de este coeficiente es llamado de coeficiente de determinación o simplemente R2. Los valores aceptados fueron R2 ≥ 0,95 y r ≥ 0,98.
En 40 de los 53 organofosforados evaluados fue posible observar que la regresión fue significativa y no demostró desvío de la linealidad en la franja evaluada (0,01 a 0,05 μg mL-1). (4)
Para los agrotóxicos diclorvós, etrinfos, forato, mevinfós, nalede y terbufós, la franja de ajuste linear solamente fue obtenida para un intervalo menor (0,02 a 0,05 μg mL-1), pues esos agrotóxicos no presentaron una buena sensibilidad en el primer punto de la curva (0,01 μg mL-1).
En la Tabla 3S, en el material suplementario, están representadas las ecuaciones de la recta de regresión empleada para la verificación del significancia de la regresión, del desvío de la linealidad y de la evaluación de la homogeneidad de la varianza de los residuos de la regresión de la curva analítica de la matriz blanca de leche, para los 49 agrotóxicos estudiados y los 4 productos de degradación. En la misma tabla también consta el análisis estadístico utilizado para evaluar la varianza de los residuos provenientes del ajuste de la curva analítica y está demostrado que todos los agrotóxicos analizados presentaron comportamiento "homocedástico" (Ccalculado < Ctabulado).
Todos los agrotóxicos evaluados presentaron el valor de R2 dentro de la franja aceptable (R2 ≥ 0,95 y r ≥ 0,98).
Límites de detección y de cuantificación del método
Los valores de LDM y LQM, obtenidos por S/R, se encuentran en las Tablas 1 y 2. Los agrotóxicos de S1 (acefato, azinfós-etílico, carbofenotiona, disulfotom-S-sulfurom, fosalona, metidationa, ometoato, pirazofós, profenofós y protiofós) y los de S2 (fosfamidona, malaoxon, pirimifós-etílico, clorfenvinfós, tetraclorvinfós, iodofenfós, fenamifós, vamidotiona, sulprofós, triazofós, piridafentiona, fosmete, sulprofós, triazofós, piridafentiona y fosmete) no presentaron S/R en la proporción 3:1 en la concentración de 0,01 mg kg-1. Por esta razón, se aumentó la concentración de esos agrotóxicos, de tal forma para obtenerse un S/R 3:1. Las etapas de recuperación y repetitividad fueron también evaluadas con esta misma concentración. Los valores de LQM en la franja de 0,002 a 0,009 mg kg-1 fueron obtenidos para la mayoría de los agrotóxicos evaluados (cerca de 57%) para la franja de 0,01 a 0,09 mg kg-1 (cerca del 44%). El agrotóxico iodofenfós presentó un LQM de 0,430 mg kg-1, un valor muy por encima del LQM adecuado a un análisis de residuos, hecho que debe estar relacionado a la baja selectividad del detector FPD, en el modo fósforo (P), al agrotóxico que posee solamente un P en su molécula. Nuevas evaluaciones podrán ser hechas para la sustancia en el mismo sistema de detección (FPD) en el modo azufre (S), pues el agrotóxico posee dos S en su molécula. El iodofenfós tiene uso permitido en productos desinfectantes, no siendo indicado para uso en corrales y/o instalaciones lecheras. Considerando que algunos agrotóxicos (Tabla 1) presentan valores de LQM inferiores al menor punto de la curva analítica, se adoptó el valor de 0,01 mg kg-1 como LQM, para todos los analitos evaluados en la determinación de rutina de esta matriz.
Recuperación y repetitividad
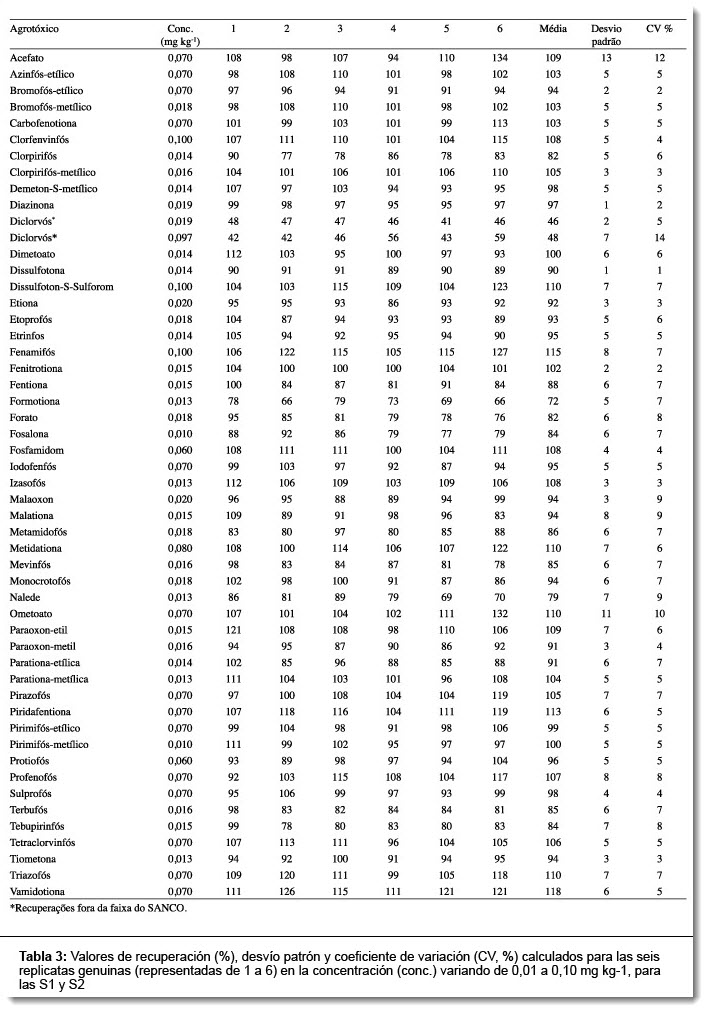
Los resultados de la recuperación y de la repetitividad de las seis replicatas de los agrotóxicos presentes en las S1 y S2 en las concentraciones 0,01 y 0,10 mg kg-1 se encuentran en la Tabla 3. Los valores de recuperación referentes a la media de las replicatas fueron adecuados para todos los agrotóxicos evaluados (franja 70% a 120%), excepto para el diclorvós. Aún para el diclorvós se analizó con la concentración de 0,097 mg kg-1; en ésta concentración los valores de recuperación también no se mostraron adecuados. Con esa evaluación fue posible demostrar que los LQM obtenidos para los organofosforados son adecuados, pues los valores de los desvíos patrón y los coeficientes de variación obtenidos, en la recuperación y repetitividad, fueron compatibles con los parámetros de la SANCO. (13)
Conclusión El método QuEChERS demostró ser eficiente para los 52 agrotóxicos y/o derivados de entre los 53 evaluados en las matrices de leche integral y pasteurizado. Los LQM obtenidos se mostraron eficientes para atender a las especificaciones del MAPA19 en lo que se refiere a los LMRs. Como no fueron obtenidos resultados satisfactorios para el diclorvós y teniendo en cuenta que es un agrotóxico muy utilizado en la medicina veterinaria y que sus residuos pueden contaminar la leche consumida por la población, deberán realizarse estudios para la implantación de un método analítico adecuado para su análisis.
Material Suplementario Está disponible en http://quimicanova.sbq.org.br, en la forma de archivo PDF, con acceso libre. La Tabla 1S presenta el efecto matriz identificado en la matriz leche por organofosforados para los 5 niveles de concentración estudiados. La Tabla 2S presenta los resultados de recuperación (%) obtenidos en la leche en 6 diferentes combinaciones de sorbentes, para los organofosforados estudiados. La Tabla 3S presenta la representación de la ecuación de la recta y la regresión, coeficientes de determinación para las franjas de trabajo estudiadas y la evaluación de la homogeneidad de la varianza de los residuos de la regresión de la curva analítica en el extracto orgánico en leche para los agrotóxicos estudiados.
Autores
Lucia Helena Pinto Bastos (*), Adherlene Vieira Gouvêa, Fabiola Málaga, Maria Helena Wohlers Morelli Cardoso, Silvana de Couto Jacob y Armi Wanderley da Nóbrega. Departamento de Química, Instituto Nacional de Controle de Qualidade em Saúde, Fundação Osvaldo Cruz. (Avenida Brasil 4365, CEP 21045-900, Rio de Janeiro, RJ, Brasil).
Contacto *e-mail: lucia.bastos@incqs.fiocruz.br
Agradecimientos
Al Consejo Nacional de Desenvolvimiento Científico y Tecnológico (CNPQ) y a la Fundación de Estudios y Proyectos del Ministerio de la Ciencia y Tecnología (FINEP).
Referencias
1. Sampaio, I. A.; comunicación pessoal.
2. Melgar, M. J.; Santaeufemia, M.; Garcia, A. M. J.; J.Environ. Sci. Health, Part B 2010, 45, 595.
3. Jardim, A. N. O.; Caldas, E. D.; Quim. Nova 2009, 32, 1898.
4. Kan, A. C.; R. Bras. Zootec. 2009, 38, 423.
5. Bastos, L. H. P.; Cardoso, M. H. W. M.; Nóbrega, A. W.; Jacob, S. C.; Cad. Saúde Colet. 2011,19, 51.
6. http://www.anvisa.gov.br, acessada em Abril 2012.
7. Prestes, D. O.; Adaime, M. B.; Zanella, R.; Scientia Chromatographica 2011, 3, 51.
8. Prestes, D. O.; Friggi, C. A .; Adaime, M. B.; Zanella, R.; Quim. Nova 2009, 32, 1620.
9. Anastassiades, M.; Lehotay, S. J.; Stajnbaher, D.; Schenck, F. J.; J. AOAC Int. 2003, 86, 412.
10. Lehotay, S. J.; Mástovská, K.; Ligtfield, R.; J. AOAC Int. 2005, 88, 615.
11. Jeong, I-S.; Kwak, B-M.; Jeong, S-H.; Food Chem. 2012, 133, 473.
12. Lehotay, S. J.; Mástovská, K.; J. AOAC Int. 2005, 88, 630.
13. European Community; Method validation and quality control procedures for pesticide residues analysis in food and feed, Document N° SANCO/ 2009/10684, Sweden, 2009.
14. United States Department of Agriculture; Chemical Compounds, PDP Commodity Grouping, Method Validation and Quality Control SOP No PDP- QC. 2010, Rev 01, Washington, 2010.
15. Thompson, M.; Ellison, S. L. R.; Wood, R.; Pure Appl. Chem. 2006, 78, 145.
16. Cardoso, M. H. W.; Gouvêa, A. V.; Nóbrega, A. W.; Abrantes, S. M. P.; Ciênc. Tecnol. Aliment. 2010, 30, 63.
17. Codex Alimentarius Comission; Pesticide residues in food: methods of analysis and sampling, 2nd ed., 2000, vol. 2A, part 1, Rome.
18. http://www.sindan.org.br, acessada em Abril 2012.
19. Ministério da Agricultura, Pecuária e Abastecimento; Instrución Normativa n° 24, Diário Oficial da União, 11 de agosto de 2011, n° 154.
Fuente: Química Nova – Vol. 35, No. 8, 1657-1663, 2012
A pesar de que el 15% de los organofosforados estudiados no poseen el uso permitido dentro del territorio brasileño, fueron incluidos en la validación de método por las necesidades nacionales de análisis de las buenas prácticas agrícolas. Los agrotóxicos clorfenvinfós, clorpirifós, diazinona, diclorvós, etiona y fenitrotiona son utilizados en medicamentos veterinarios para el combate a ectoparasitos y, excepto el diclorvós, son también utilizados en hortofrutícolas de granja, cereales y desinfectantes, representando cuatro posibles medios de dejar sus residuos en la leche. (4,6)
La complejidad de la composición de los alimentos trae dificultades para la cuantificación de los agrotóxicos, siendo necesaria una etapa de limpieza do extracto (clean up) para reducir las interferencias luego de la extracción con solvente. Estas dificultades fueron minimizadas luego del desarrollo de métodos multi-residuales que hicieron posible el análisis de un gran número de sustancias con altos porcentajes de recuperación (exactitud) de los analitos y la remoción de las posibles interferencias de la muestra; presentaron una buena precisión y robustez y redujeron el trabajo técnico y el uso de solventes. (7,8)
Teniendo en cuenta que la legislación brasileña permite el uso de más de 200 ingredientes activos en la agricultura y como desinfectantes, la utilización de métodos multi-residuales es importante para agilizar el trabajo analítico y así responder a las demandas de la salud pública. (3)
Se introdujo un nuevo método de preparación de muestra para la extracción de residuos de agrotóxicos que recibió el nombre de fantasía de QuEChERS. Este método busca reflejar las mayores ventajas (Quick, Easy, Cheap, Effective, Rugged, Safe), o sea, ser rápido, fácil, económico, efectivo, robusto y seguro.
Las etapas que conforman el método son extracción con acetonitrilo seguido de partición, promovida por la adición de sales (sulfato de magnesio-MgSO4), cloruro de sodio (NaCl) y/o acetato de sodio (Na(C2H3O2) y limpieza de la muestra con sorbentes, como C18, alúmina, PSA (primary secondary amine) y carbono con grafito (para uso en muestras con clorofila).
La utilización del solvente acetonitrilo permite la extracción de una amplia franja de agrotóxicos con diferentes polaridades y cuando es acidificada, favorece la extracción de sustancias que presentan problemas de estabilidad en un medio básico. El uso de acetonitrilo, no es adecuado para análisis en cromatografía a gas en el modo splitless, debido a su gran expansión de volumen durante la vaporización, lo que puede interferir en los detectores selectivos y favorecer la degradación de algunos agrotóxicos. (10)
En función de esto en este estudio, luego del proceso de extracción con acetonitrilo, en la etapa final el extracto orgánico fue secado y el solvente reemplazado por acetato de etilo, más adecuado a la cromatografía a gas con detección por fotometría de llama (CG-DFC). La utilización de la sal secante, sulfato de magnesio, tiene como objetivo la remoción del agua y el favorecer la recuperación de los agrotóxicos polares. En contrapartida, la hidratación del sulfato de magnesio, genera una reacción exotérmica que calienta la muestra a temperaturas de 40°C a 45°C en la etapa de extracción/partición, favoreciendo la recuperación de los agrotóxicos apolares. (11)
El método QuEChERS introdujo una nueva denominación al procedimiento de limpieza de la muestra, llamada de extracción en fase sólida dispersiva (D-SPE) en la cual, diferentemente del procedimiento de limpieza tradicional (SPE) que utiliza cartuchos ó columnas, los sorbentes son adicionados directamente al extracto orgánico y permiten que la limpieza de la muestra y la reducción del agua residual sean realizados concomitantemente. (9) El método ha demostrado ser el adecuado también para muestras con bajos tenores de gordura (< 2% de gordura) con la leche (12) pasteurizada a Ultra-alta temperatura (UAT).
El objetivo del trabajo fue la implementación del método de extracción dispersiva QuEChERS en la leche integral UAT en embalaje Tetra Pak y leche pasteurizada en embalaje plástico, para la determinación de residuos de agrotóxicos de la clase de los organofosforados. Fueron analizados 49 agrotóxicos de la clase de los organofosforados y 4 productos de degradación, totalizando 53 sustancias.
Parte Experimental
Muestras de leche blanca (matriz)
Dos muestras de leche integral provenientes del estado de Minas Gerais – una en embalaje Tetra Pak (UAT) y otra en embalaje plástico (leche pasteurizada tipo A) – fueron analizadas en la etapa de implementación del método. Como en los respectivos rótulos constaba la información de que ambas eran de procedencia orgánica, fue efectuado un análisis previo para confirmar la ausencia de los agrotóxicos en estudio.
Patrones y reactivos
La mayoría de los patrones de agrotóxicos certificados de la clase de los organofosforados, posee grado de pureza superior a 95% (Dr. Ehrenstorfer – Augsburg, Alemanha), excepto los agrotóxicos: tiometona (48%), profenofós (92%), mevinfós (91%), etoprofós (93%), terbufós (93%), etrinfos (60%), fosfamidona (92,5%), formotiona (92%), fenamifós (92,5%) y triazofós (78%).
Fueron utilizados acetonitrilo, iso-octano y acetato de etilo, solventes orgánicos de alta pureza y grado cromatográfico (Merck y Tedia); MgSO4 PA (Merck); sorbente Bondesil-PSA 40 mm (Varian); C18 35-75 mm (Alltech); Al2O3, 90, neutro70-230 # ASTM (Merck), previamente pasado por mufla a 550°C por 3 horas y Na(C2H3O2) anidro (Spectrum) secado a 220°C por 3 horas antes de ser usado.
Soluciones de stock
Fueron preparadas 53 soluciones de stock (SS) de los agrotóxicos y/o derivados a ser evaluados en solvente acetato de etilo en la concentración nominal de 100 mg mL-1.
Soluciones intermediarias
A partir de las soluciones de stock (SS), fueron preparadas dos soluciones distintas (S1 y S2) intermediarias de trabajo. La elección de los agrotóxicos de cada solución fue hecha en función del tiempo de retención de cada sustancia, de modo que no hubiese dos con el mismo tiempo de retención en minutos (tR min), haciendo posible de esa forma, una separación inequívoca de todos los organofosforados evaluados. Cuando se detecta en la determinación analítica de una muestra desconocida, la presencia de agrotóxicos con el mesmo "tR min", la identidad del analito deberá ser confirmada por el empleo de por lo menos, uno de los siguientes procedimientos: (13) otra columna con fase estacionaria de polaridad diferente, otro detector ó espectrometría de masas con identificación por la biblioteca de espectros de los agrotóxicos.
La S1 fue compuesta de los siguientes agrotóxicos y de productos de degradación, ordenados en orden crescente de "tR min", entre paréntesis: nalede (3,694), metamidofós (4,322), acefato (7,287), demetom-S-metílico (10,228), ometoato (11,482), tiometona (12,403), diazinona (13,291), dissulfotom (14,770), isazofós (17,123), clorpirifós-metil (19,805), parationa-metílica (21,560), pirimifós-metílico (22,053), paraoxon etílico (22,440), fenitrotiona (24,385), parationa-etílica (24,945), bromofós-metílico (29,762), bromofós-etílico (29,762), protiofós (33,690), profenofós (37,002), dissulfotom-S-sulfurona (40,815), etiona (40,950), metidationa (44,849), carbofenotiona (48,435), fosalona (66,500), pirazofós (69,337) y azinfós-Etílico (72,718). El paraoxon-etílico y la disulfotom-S-sulfurona son productos de degradación de la parationa-etílica y del disulfotom, respectivamente.
La S2 fue compuesta de los siguientes agrotóxicos y de dos de los productos de degradación, también ordenados en orden creciente de "tR min": diclorvós (3,699), mevinfós (5,710), etoprofós (9,105), forato (11,315), terbufós (12,411), tebupirinfós (12,571), monocrotofós (14,589), etrinfos (15,241), dimetoato (16,403), paraoxon-metílico (20,634), fosfamidona (21,813), formotiona (22,180), malaoxon (23,509), clorpirifós (24,646), malationa (25,545), pirimifós-etílico (27,276), fentiona (27,803), clorfenvinfós (30,705), tetraclorvinfós (35,711), iodofenfós (37,429), fenamifós (38,004), vamidotiona (41,968), sulprofós (47,676), triazofós (55,106), piridafentiona (63,645), fosmete (66,536), azinfós-metílico (71,084). El paraoxon-metílico y el malaoxon son productos de degradación da parationa-metílica y malationa, respectivamente.
Las Figuras 1 y 2 presentan los cromatogramas de las S1 y S2 de los agrotóxicos estudiados en la matriz de leche.
Las S1 y S2 fueron utilizadas para preparar las curvas analíticas en acetato de etilo, en el extracto de leche orgánico blanco y en la fortificación del leche blanco en el estudio de la tasa de recuperación.
Soluciones intermediarias utilizadas en la calidad garantizada
Para garantizar el control individual del proceso analítico y la validad de los resultados, fueron utilizadas dos soluciones intermediarias (QA1 y QA2): clorpirifós-metil, en la concentración nominal de 0,3 μg mL-1 en el solvente de acetato de etilo (QA1), fue escogido por mL-1 por representar adecuadamente las características físicas y químicas de la clase de los organofosforados.(14)
Los resultados analíticos de la muestra son considerados válidos si la recuperación del clorpirifós-metil estuviese entre 70% y 120%. En el caso contrario, debe verificarse todo el procedimiento realizado y si fuese necesario, repetir el proceso de extracción y limpieza de la muestra. (13)
Para el control del equipo, la parationa-metílica, en la concentración nominal de 1 μg mL-1 en acetato de etilo (QA2), fue adicionada en el inicio de cada secuencia de inyección, con el objetivo de monitorear el sistema cromatográfico en el momento del análisis de las muestras.
El criterio de evaluación adoptado fue el CV de 10% para el área obtenida en el QA2. Con todo así un nuevo CV podrá ser determinado con base en una serie histórica de sucesivas evaluaciones.
Condiciones Cromatográficas
Equipo: Cromatógrafo a Gas HP 7890 (Agilent), equipado con detector por fotometría de llama (CG-DFC) en modo fósforo (P); sistema de inyección automático y estación de trabajo - ChemStation. Temperaturas del inyector y detector de 230ºC y 250ºC, respectivamente. Columna 50% fenil-metil siloxano (DB-17MS) con 30 m de longitud; 0,25 mm de d.i. y 0,25 mm de espesura del film. Programación de temperatura del horno de 100ºC (0 min), 25 ºC/min a 170ºC (1 min), 1 ºC/min a 180ºC (1 min), 1 ºC/min hasta 230°C (0 min), 5 °C/min hasta 260°C (5 min), 20 ºC/min hasta 280°C (10 min). Flujo de gas portador (hélio) = 1,5 mL min-1, flujo de la purga del septo = 3,0 mL min-1, flujo total = 61,5 mL min-1, flujo del gás make-up (nitrógeno) = 60 mL min-1, modo de inyección splitless = 1,0 min, volumen inyectado = 1,0 mL.
El tiempo total de la corrida fue de 80 min y la integración fue hecha por el parámetro del área de los picos.
Procedimiento analítico multi-residuos
El método multi-resíduos utilizado fue basado en la metodología (9) desarrollada en 2003, denominada QuEChERS.
Extracción de los agrotóxicos
Cerca de 15 g de la muestra, luego de la homogeneización por 5 min en licuadora de vaso de vidrio, fueron pesadas y colocadas en frasco de 50 mL para uso en centrífuga. En seguida, fue añadido 1 mL del QA1 (clorpirifós-metil) y homogeneizado. Luego de 25 min, fue iniciada la extracción con la adición de 15 mL de acetonitrilo (1% ácido acético) y agitación en Vortex. Fueron realizadas dos etapas de la limpieza de la muestra con extracción en fase sólida dispersiva (SPE-D): en la primera, fueron añadidos MgSO4 + 1,5 g Na(C2H3O2) y en la segunda, fueron estudiadas varias combinaciones de sorbentes, que se encuentran indicados en el listado abajo citado de este texto. El diagrama de dos etapas de extracción dispersiva se encuentra representado en la Figura 3.
Criterios utilizados en la evaluación do método
El primer criterio a ser evaluado fue el de la selectividad, luego de este se evaluó la mejor combinación de sorbentes en la fase estacionaria para la segunda etapa de la SPE-D, el efecto matriz, la linealidad, la precisión, la exactitud, los limites de detección y cuantificación.
Selectividad
Las muestras blanco matriz de la leche fueron sometidas al método de extracción de organofosforados y la selectividad fue confirmada por la ausencia de picos en los tiempos de retención de las sustancias estudiadas presentes en las S1 y S2. (14)

Evaluación de la mejor combinación de sorbentes para la extracción en fase sólida dispersiva (SPE-D)
Las muestras blanco fueron fortificadas, respectivamente, con las concentraciones que variaron de 0,050 a 0,100 mg kg-1 de las S1 y S2, de acuerdo con los organofosforados estudiados. Luego de 25 min de la fortificación, que permitió la interacción entre el agrotóxico y la matriz, se inició el proceso de extracción. Fueron utilizadas seis diferentes combinaciones de sorbentes para la evaluación de la mejor tasa de recuperación de los organofosforados adicionados en la S1 y S2: A) 50 mg PSA + 150 mg MgSO4; B) 50 mg C18 + 150 mg MgSO4; C) 50 mg alúmina + 150 mg MgSO4; D) 50 mg PSA + 50 mg C18 + 150 mg MgSO4; E) 50 mg PSA + 50 mg alúmina + 150 mg MgSO4 y F) 50 mg PSA + 50 mg C18 + 50 mg alúmina + 150 mg MgSO4.
En seguida, las recuperaciones de los 53 analitos presentes en la S1 y S2 fueron evaluadas y comparadas con la concentración real de las muestras fortificadas (leche con S1 o S2).
Efecto de la respuesta cromatográfica acentuada e inducida por la matriz blanco de leche
La naturaleza de la matriz ("efecto matriz") - solventes orgánicos (15) o el extracto de la muestra - que contiene los analitos puede aumentar o disminuir la respuesta del detector.
Para evaluarse este efecto, se siguió el procedimiento (16) que identificó la respuesta cromatográfica de cada organofosforado en el solvente y en la matriz de tomate. Se utilizó la matriz leche integral UAT y fueron analizadas las soluciones S1 y S2 en cinco diferentes niveles, correspondientes a las concentraciones nominales de 0,01; 0,02; 0,03; 0,04 y 0,05 mg mL-1.
Estudio de la linealidad de la franja de trabajo
Para el estudio de la linealidad de la franja de trabajo, 1 mL del extracto orgánico del blanco de leche, colocado en frascos de vidrio de 3 mL, fue secado en una atmósfera de N2. En seguida, se le añadió 1 mL de los extractos orgánicos S1 y S2, respectivamente, en las concentraciones correspondientes a los puntos de la curva analítica (0,01 a 0,05 mg mL-1).
El volumen de 1 μL de cada concentración fue inyectado en triplicata en el sistema CG-DFC y para los cálculos estadísticos, se utilizó el valor medio de los resultados obtenidos.
La linealidad de la franja de trabajo fue verificada a través de la lectura de la curva analítica, utilizando el método de los mínimos cuadrados ordinarios (MMQO). (16)
Límites de detección y de cuantificación del instrumento y del método
Los límites de detección y cuantificación del instrumento (LDI y LQI) y del método (LDM y LQM) fueron establecidos con base al método de la relación señal/ruido (S/R), en el cual se acepta la estimación de 3:1 para el LD y de 10:1 para el LQ, o sea, el ruido producido por la respuesta de la inyección de concentraciones conocidas de los analitos de interés debe ser tres veces mayor de que el ruido producido por el sistema cromatográfico de la línea de base para el LD y diez veces para el LQ.16 Esta relación (S/R) fue calculada por la ChemStation del cromatógrafo HP-7890.
Para establecer esta relación para los valores de los LDI y LQI se utilizó una concentración conocida con aproximadamente 0,01 mg mL-1 de todos los agrotóxicos en matriz (extracto blanco de la pulpa de leche en acetato de etilo), analizados en tres replicatas genuinas (n = 3).
Para el cálculo de LDM y LQM, seis replicatas genuinas de la muestra blanca de leche fueron fortificadas con la concentración de aproximadamente 0,01 mg mL-1 y analizadas por el método de ensayo. Los resultados obtenidos fueron utilizados para establecer la relación (S/R). En seguida, se calcularon las medias, los desvíos patrón de los resultados y los valores de los límites LDI, LQI, LDM y LQM.
Para confirmación de los resultados de los analitos fueron preparadas seis replicatas de la muestra blanco de leche en las concentraciones obtenidas de los LQM, calculados de cada analito analizado de acuerdo con el método de ensayo. En el caso de los analitos cuyos valores S/R no fueron iguales o superiores a 3:1, las concentraciones individuales fueron aumentadas, lo que permitió la obtención de valores más próximos del LDM y LQM.
Recuperación y repetitividad
El mismo procedimiento utilizado para el cálculo del LDM y del LQM fue usado para el cálculo de la tasa de recuperación y repetitividad de los 53 analitos y los criterios de aceptación fueron los indicados por el Codex Alimentarius (17) y SANCO (13): para la franja de concentración de este estudio (>0,01 y ≤ 0,1 mg kg-1), el intervalo de recuperación debe ser de 70% a 120% y los coeficientes de variación (CV) deben ser inferiores a 20%.
Resultados y Discusión
Selectividad
Las dos muestras blanco de leche utilizadas como matriz fueron adecuadas para la evaluación del método, por no haber presentado tR min iguales a los de los agrotóxicos en estudio.
Evaluación de mejor combinación de sorbentes para la utilización en la segunda fase dispersiva
De entre las seis combinaciones de sorbentes analizadas, apenas las con 50 mg PSA + 50 mg alúmina + 150 mg MgSO4 y con 50 mg PSA + 50 mg C18 + 50 mg alúmina + 150 mg MgSO4 demostraron mayor uniformidad en las recuperaciones para el conjunto de agrotóxicos evaluados en las mezclas S1 y S2, considerando la franja estipulada por el SANCO (13) (70% a 120%). La combinación 50 mg PSA + 50 mg alúmina + 150 mg MgSO4 fue la escogida, para ser utilizada en la segunda fase dispersiva, por presentar un desempeño mejor para los organofosforados acefato y clorfenvinfós (99 y 81%, respectivamente), cuando comparada con la de 50 mg PSA + 50 mg C18 + 50 mg alúmina + 150 mg MgSO4 (65 y 63%) y por utilizar una fase dispersiva a menos (C18).
En un trabajo anterior (12) el método Quechers en leche (tipo de leche no especificado) fue evaluado por CG-MS para diferentes agrotóxicos, de entre esos el acefato. Fue obtenida una recuperación para el agrotóxico estudiado de 107% (n = 3), en la concentración de 0,05 mg kg-1, utilizando la fase dispersiva 50 mg PSA + 50 mg C18 + 150 mg MgSO4. En este estudio solamente fue evaluada esa combinación, no habiendo sido evaluado también el agrotóxico clorfenvinfós.
Para los agrotóxicos estudiados (S1 y S2), las concentraciones utilizadas para fortificar la matriz y los resultados de las recuperaciones obtenidas con las seis diferentes combinaciones de sorbentes están descriptas en la Tabla 2S, material suplementario, en la cual es posible verificar las mejores tasas de recuperación (70% a 120%) en un mayor número de agrotóxicos evaluados. El agrotóxico diclorvós - también denominado DDVP – no presentó una recuperación adecuada con ninguna de las combinaciones estudiadas, lo que puede estar relacionado a varios factores, como la integridad del material de referencia utilizado o la extracción de la molécula.
El trabajo de monitoreo realizado en España (2) mostró la presencia de residuos de diclorvós en 5,78% de las muestras evaluadas en leche cruda.
Como el DDVP está presente en 39 medicamentos veterinarios antiparasitarios y es también un producto de degradación de 21 productos cuyo ingrediente activo es el triclorfom (no evaluado en este método), ambos utilizados en el ganado lechero, conforme los registros en el MAPA18, nuevos estudios deberán ser realizados para adecuar un método para análisis de este organofosforado.
Efecto de la respuesta cromatográfica acentuada e inducida por la matriz blanco de leche
En 30% de todos los agrotóxicos analizados - acefato, azinfós-etílico, demetom-S-metílico, dimetoato, fenamifós, formotiona fosfamidona, fosmete, malaoxon, metamidofós, ometoato, paraoxon-metílico, profenofós, monocrotofós, piridafentiona, tetraclorvinfós, triazofós y vamidotiona - el efecto matriz fue significante en los cinco niveles analizados.
En 12% - azinfós-metilico, etoprofós, nalede, protiofós, fentiona, pirimifós-etílico, terbufós - no fue demostrado efecto matriz en ninguno de los niveles evaluados (0,01; 0,02; 0,03; 0,04 y 0,05 mg mL-1). En los 58% restantes, correspondientes a los 28 agrotóxicos, el efecto matriz fue observado en al menos un nivel. El detalle de la presencia del efecto matriz en diferentes niveles se encuentra representado en la Tabla 1S del material suplementario.
Teniendo en cuenta el efecto matriz blanco de leche fue significante para la mayoría de los organofosforados analizados, se utilizó una curva con matriz para determinar la linealidad y la franja de trabajo.
Estudio de la linealidad y de la franja de trabajo
La correlación de la curva analítica, representada por el modelo matemático entre los valores numéricos de x y de y, es indicada por el coeficiente de Pearson – 'r'. El cuadrado de este coeficiente es llamado de coeficiente de determinación o simplemente R2. Los valores aceptados fueron R2 ≥ 0,95 y r ≥ 0,98.
En 40 de los 53 organofosforados evaluados fue posible observar que la regresión fue significativa y no demostró desvío de la linealidad en la franja evaluada (0,01 a 0,05 μg mL-1). (4)
Para los agrotóxicos diclorvós, etrinfos, forato, mevinfós, nalede y terbufós, la franja de ajuste linear solamente fue obtenida para un intervalo menor (0,02 a 0,05 μg mL-1), pues esos agrotóxicos no presentaron una buena sensibilidad en el primer punto de la curva (0,01 μg mL-1).
En la Tabla 3S, en el material suplementario, están representadas las ecuaciones de la recta de regresión empleada para la verificación del significancia de la regresión, del desvío de la linealidad y de la evaluación de la homogeneidad de la varianza de los residuos de la regresión de la curva analítica de la matriz blanca de leche, para los 49 agrotóxicos estudiados y los 4 productos de degradación. En la misma tabla también consta el análisis estadístico utilizado para evaluar la varianza de los residuos provenientes del ajuste de la curva analítica y está demostrado que todos los agrotóxicos analizados presentaron comportamiento "homocedástico" (Ccalculado < Ctabulado).
Todos los agrotóxicos evaluados presentaron el valor de R2 dentro de la franja aceptable (R2 ≥ 0,95 y r ≥ 0,98).
Límites de detección y de cuantificación del método
Los valores de LDM y LQM, obtenidos por S/R, se encuentran en las Tablas 1 y 2. Los agrotóxicos de S1 (acefato, azinfós-etílico, carbofenotiona, disulfotom-S-sulfurom, fosalona, metidationa, ometoato, pirazofós, profenofós y protiofós) y los de S2 (fosfamidona, malaoxon, pirimifós-etílico, clorfenvinfós, tetraclorvinfós, iodofenfós, fenamifós, vamidotiona, sulprofós, triazofós, piridafentiona, fosmete, sulprofós, triazofós, piridafentiona y fosmete) no presentaron S/R en la proporción 3:1 en la concentración de 0,01 mg kg-1. Por esta razón, se aumentó la concentración de esos agrotóxicos, de tal forma para obtenerse un S/R 3:1. Las etapas de recuperación y repetitividad fueron también evaluadas con esta misma concentración. Los valores de LQM en la franja de 0,002 a 0,009 mg kg-1 fueron obtenidos para la mayoría de los agrotóxicos evaluados (cerca de 57%) para la franja de 0,01 a 0,09 mg kg-1 (cerca del 44%). El agrotóxico iodofenfós presentó un LQM de 0,430 mg kg-1, un valor muy por encima del LQM adecuado a un análisis de residuos, hecho que debe estar relacionado a la baja selectividad del detector FPD, en el modo fósforo (P), al agrotóxico que posee solamente un P en su molécula. Nuevas evaluaciones podrán ser hechas para la sustancia en el mismo sistema de detección (FPD) en el modo azufre (S), pues el agrotóxico posee dos S en su molécula. El iodofenfós tiene uso permitido en productos desinfectantes, no siendo indicado para uso en corrales y/o instalaciones lecheras. Considerando que algunos agrotóxicos (Tabla 1) presentan valores de LQM inferiores al menor punto de la curva analítica, se adoptó el valor de 0,01 mg kg-1 como LQM, para todos los analitos evaluados en la determinación de rutina de esta matriz.
Recuperación y repetitividad
Los resultados de la recuperación y de la repetitividad de las seis replicatas de los agrotóxicos presentes en las S1 y S2 en las concentraciones 0,01 y 0,10 mg kg-1 se encuentran en la Tabla 3. Los valores de recuperación referentes a la media de las replicatas fueron adecuados para todos los agrotóxicos evaluados (franja 70% a 120%), excepto para el diclorvós. Aún para el diclorvós se analizó con la concentración de 0,097 mg kg-1; en ésta concentración los valores de recuperación también no se mostraron adecuados. Con esa evaluación fue posible demostrar que los LQM obtenidos para los organofosforados son adecuados, pues los valores de los desvíos patrón y los coeficientes de variación obtenidos, en la recuperación y repetitividad, fueron compatibles con los parámetros de la SANCO. (13)
Conclusión El método QuEChERS demostró ser eficiente para los 52 agrotóxicos y/o derivados de entre los 53 evaluados en las matrices de leche integral y pasteurizado. Los LQM obtenidos se mostraron eficientes para atender a las especificaciones del MAPA19 en lo que se refiere a los LMRs. Como no fueron obtenidos resultados satisfactorios para el diclorvós y teniendo en cuenta que es un agrotóxico muy utilizado en la medicina veterinaria y que sus residuos pueden contaminar la leche consumida por la población, deberán realizarse estudios para la implantación de un método analítico adecuado para su análisis.
Material Suplementario Está disponible en http://quimicanova.sbq.org.br, en la forma de archivo PDF, con acceso libre. La Tabla 1S presenta el efecto matriz identificado en la matriz leche por organofosforados para los 5 niveles de concentración estudiados. La Tabla 2S presenta los resultados de recuperación (%) obtenidos en la leche en 6 diferentes combinaciones de sorbentes, para los organofosforados estudiados. La Tabla 3S presenta la representación de la ecuación de la recta y la regresión, coeficientes de determinación para las franjas de trabajo estudiadas y la evaluación de la homogeneidad de la varianza de los residuos de la regresión de la curva analítica en el extracto orgánico en leche para los agrotóxicos estudiados.
Autores
Lucia Helena Pinto Bastos (*), Adherlene Vieira Gouvêa, Fabiola Málaga, Maria Helena Wohlers Morelli Cardoso, Silvana de Couto Jacob y Armi Wanderley da Nóbrega. Departamento de Química, Instituto Nacional de Controle de Qualidade em Saúde, Fundação Osvaldo Cruz. (Avenida Brasil 4365, CEP 21045-900, Rio de Janeiro, RJ, Brasil).
Contacto *e-mail: lucia.bastos@incqs.fiocruz.br
Agradecimientos
Al Consejo Nacional de Desenvolvimiento Científico y Tecnológico (CNPQ) y a la Fundación de Estudios y Proyectos del Ministerio de la Ciencia y Tecnología (FINEP).
Referencias
1. Sampaio, I. A.; comunicación pessoal.
2. Melgar, M. J.; Santaeufemia, M.; Garcia, A. M. J.; J.Environ. Sci. Health, Part B 2010, 45, 595.
3. Jardim, A. N. O.; Caldas, E. D.; Quim. Nova 2009, 32, 1898.
4. Kan, A. C.; R. Bras. Zootec. 2009, 38, 423.
5. Bastos, L. H. P.; Cardoso, M. H. W. M.; Nóbrega, A. W.; Jacob, S. C.; Cad. Saúde Colet. 2011,19, 51.
6. http://www.anvisa.gov.br, acessada em Abril 2012.
7. Prestes, D. O.; Adaime, M. B.; Zanella, R.; Scientia Chromatographica 2011, 3, 51.
8. Prestes, D. O.; Friggi, C. A .; Adaime, M. B.; Zanella, R.; Quim. Nova 2009, 32, 1620.
9. Anastassiades, M.; Lehotay, S. J.; Stajnbaher, D.; Schenck, F. J.; J. AOAC Int. 2003, 86, 412.
10. Lehotay, S. J.; Mástovská, K.; Ligtfield, R.; J. AOAC Int. 2005, 88, 615.
11. Jeong, I-S.; Kwak, B-M.; Jeong, S-H.; Food Chem. 2012, 133, 473.
12. Lehotay, S. J.; Mástovská, K.; J. AOAC Int. 2005, 88, 630.
13. European Community; Method validation and quality control procedures for pesticide residues analysis in food and feed, Document N° SANCO/ 2009/10684, Sweden, 2009.
14. United States Department of Agriculture; Chemical Compounds, PDP Commodity Grouping, Method Validation and Quality Control SOP No PDP- QC. 2010, Rev 01, Washington, 2010.
15. Thompson, M.; Ellison, S. L. R.; Wood, R.; Pure Appl. Chem. 2006, 78, 145.
16. Cardoso, M. H. W.; Gouvêa, A. V.; Nóbrega, A. W.; Abrantes, S. M. P.; Ciênc. Tecnol. Aliment. 2010, 30, 63.
17. Codex Alimentarius Comission; Pesticide residues in food: methods of analysis and sampling, 2nd ed., 2000, vol. 2A, part 1, Rome.
18. http://www.sindan.org.br, acessada em Abril 2012.
19. Ministério da Agricultura, Pecuária e Abastecimento; Instrución Normativa n° 24, Diário Oficial da União, 11 de agosto de 2011, n° 154.
Fuente: Química Nova – Vol. 35, No. 8, 1657-1663, 2012













































No hay comentarios:
Publicar un comentario
Bienvenido a Avibert.
Deja habilitado el acceso a tu perfil o indica un enlace a tu blog o sitio, para que la comunicación sea mas fluida.
Saludos y gracias por comentar!